L’optogénétique est une technique alliant l’ingénierie biophotonique à la thérapie génique, afin de rendre les neurones sensibles à la lumière. Elle permet d’allumer sélectivement des circuits de neurones préalablement transfectés par génie génétique pour synthétiser des protéines sensibles à la lumière de la famille des opsines. Cette technique est une avancée sans précédent dans les connaissances et la compréhension des circuits neuronaux, et notamment dans celles de leur organisation pour réagir à certains stimuli, consolider des apprentissages, construire la mémoire, ou encore dans la production de certains comportements.
Ces dernières décennies, les progrès en neurosciences (neurologie, psychiatrie et addictologie) sont majeurs, surtout en termes de recherche. Neurosciences, thérapie génique et optique… voilà, plusieurs domaines dont l’œil est l’interface parfaite. Il n’est donc pas surprenant que la première application thérapeutique clinique de l’optogénétique ait été permise dans le domaine de l’ophtalmologie.
Pour la première fois en 2021, cette technique a permis à un patient atteint de cécité, des suites d’une rétinopathie pigmentaire, de recouvrer partiellement la vue. Cette première mondiale a eu lieu à l’hôpital des 15-20 à Paris et a fait l’objet d’une publication scientifique dans la prestigieuse revue Nature Medicine le 24 mai 2021, sous l’égide du Pr José Alain Sahel en France. Ce travail est issu d’une collaboration entre l’Institut ophtalmologique moléculaire et clinique de Bâle (Suisse), l’Institut de la vision (Paris) et l’Université de Pittsburgh, avec la société GenSight Biologics.
Progrès des neurosciences permis par l’optogénétique
La mémoire : créer de faux souvenirs ? Effacer de vrais souvenirs ?
Notre mémoire n’est pas un simple reflet du flux d’informations reçu, mais une reconstruction active et dynamique qui trie en permanence une somme d’informations. Pour cela, une mémoire en bonne santé c’est une mémoire qui enregistre et qui efface en permanence des informations. Si cette fonction de synthèse qu’est la mémoire est active et dynamique, elle peut aussi être modifiée en activant ou désactivant des circuits neuronaux spécifiques. Ce faisant, il est possible, en théorie, de créer des “faux souvenirs” et “d’effacer certains souvenirs”. Une série d’expériences utilisant l’optogénétique chez le rongeur (depuis 2012) a en effet démontré cela (1).
La première étape de ces expériences consiste à repérer les neurones activés lors d’un apprentissage.
Puis, on fait synthétiser sélectivement à ces seuls neurones, par manipulation génétique, une protéine canal ionique activée par une stimulation lumineuse d’une longueur d’onde spécifique.
Ensuite, en appliquant cette lumière d’une longueur d’onde spécifique, on peut activer sélectivement les neurones transfectés, chez l’animal vivant.
Ces travaux ont permis à leurs auteurs, entre autres le Pr Tonegawa (Prix Nobel de médecine en 1987), de démontrer qu’il était possible de modifier dans le cerveau de rongeurs des souvenirs stockés dans leur hippocampe (1). En activant chez le rongeur in vivo par stimulation lumineuse les neurones spécifiquement activés en situation de peur, ils ont induit un comportement de peur par simple stimulation lumineuse neuronale spécifique sans contexte effrayant. Cette manipulation des circuits de la mémoire pourrait permettre une meilleure compréhension des mécanismes impliqués dans la maladie d’Alzheimer, le syndrome de stress post-traumatique, la dépression entre autres pathologies neurologiques ou psychiatriques.
Les comportements de “dominance” sous-tendus par des circuits neuronaux
Un travail publié en 2017 dans Science (2) a démontré que les comportements sociaux dits de “dominance” sont liés à l’activation d’un petit groupe de neurones du cortex préfrontal. L’activation de ces neurones permet ainsi de transformer le comportement passif d’un rongeur en comportement de mâle alpha ou mâle dominant. De plus, la succession des victoires lors de luttes entre rongeurs va renforcer ce comportement de dominance et transformer un mâle dit passif en mâle dominant, et vice versa en inhibant ces mêmes neurones.
Si ce comportement de mâle dominant est lié à un circuit neuronal cérébral, il peut, dès lors, devenir modifiable en activant ou inhibant ces circuits neuronaux spécifiques. Cet article révèle le déterminisme cérébral des comportements de mâle dominant chez le rongeur, et démontre la possible modification des comportements de dominance par activation des circuits neuronaux impliqués. L’activation sélective de ces circuits est faite par optogénétique. La stimulation de ce réseau de neurones chez le rongeur transforme durablement un mâle dominé en mâle dominant.
Une longue fibre optique est plantée dans le cerveau de deux souris mâles s’affrontant. Le cortex préfrontal dorsomédian régule la dominance sociale. Les auteurs ont identifié 31 neurones activés durant les comportements de poussée, et 25 neurones durant les comportements de résistance. Finalement, onze neurones seulement étaient spécifiquement activés à la fois durant les comportements de poussée et de résistance, caractéristiques des comportements de dominance
Cette étude décrypte aussi l’effet victoire. En effet, le renforcement des synapses de ce circuit qui relie le thalamus au cortex préfrontal explique l’effet victoire. Finalement, les souris bénéficiant de 6 stimulations ou plus provoquant une victoire conserveront durablement leur nouveau statut de mâle alpha ou dominant. Ces études nous renseignent sur le déterminisme neuronal, possiblement lié à un apprentissage des comportements sociaux de dominance.
Rôle du cervelet dans l’autisme, la schizophrénie et l’addiction ?
Le rôle du cervelet a longtemps été considéré comme purement moteur, impliqué dans le contrôle des fonctions motrices, et de l’équilibre entre autres. Cependant, plus récemment, de nombreuses études ont mis en évidence l’implication du cervelet également dans des tâches cognitives, comme la mémoire et le langage, mais aussi le comportement social. Dans un article publié dans Nature en 2018, l’équipe du Pr Khodakhah a démontré le rôle crucial des projections du cervelet vers l’aire tegmentale ventrale du cerveau située dans le mésencéphale, appartenant au système de la récompense.
Chez la souris, le cervelet se projette directement sur l’aire tegmentale ventrale (ATV) par une seule connexion. L’ATV produit de la dopamine, ce neurotransmetteur qui stimule nos comportements en créant une sensation de plaisir. Les chercheurs ont donné aux souris la possibilité d’auto-stimuler cette zone de connexion entre le cervelet et l’ATV par l’optogénétique : les animaux pouvaient activer un levier qui déclenchait le laser qui activait à son tour cette zone. Seuls les animaux vulnérables à l’addiction activaient de façon compulsive cette zone. De plus, l’activation de cette connexion était impliquée dans les interactions sociales.
Ce travail renforce l’idée que la dysfonction de ce circuit contribue au développement de l’autisme et de l’addiction, autant de pathologies dans lesquelles le système de récompense se trouve altéré. Certaines études suggèrent aussi une altération des connexions du cervelet chez des patients autistes.
Usage de l’optogénétique en ophtalmologie
Des protéines sensibles à la lumière couplées à une fonction biologique
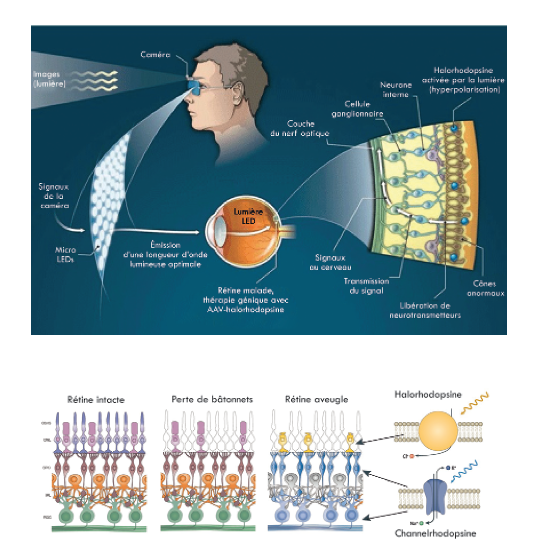
Les protéines sensibles à la lumière sont issues de la famille des opsines. Ce sont des canaux à 7 domaines transmembranaires qui sont des pompes ioniques s’ouvrant après stimulation lumineuse. Il en existe plusieurs types, stimulables par des longueurs d’onde spécifiques. Les opsines sont des protéines ubiquitaires divisées en deux catégories : les opsines microbiennes (channelrhodopsine, halorrhodopsine, etc. et les opsines animales (récepteurs couplés aux protéines G : rhodopsine, et mélanopsine). La première protéine identifiée a été la bactériorhodopsine, une protéine similaire à la rhodopsine d’origine microbienne (Halobacterium halobium) qui ouvre une pompe à protons après stimulation lumineuse.
Le gène de la channelrhodopsine est issu d’algues unicellulaires. Elle s’ouvre en lumière bleue et laisse entrer des ions Na+ dans les neurones, ce qui les dépolarise et les rend excitables.
L’halorrhodopsine est une protéine issue d’archéobactéries. C’est un canal ionique qui s’ouvre en lumière jaune et laisse entrer des ions Cl-, ce qui hyperpolarise les neurones et les rend inexcitables.
L’introduction d’opsines microbiennes dans un type cellulaire le rend sensible à la stimulation lumineuse, rapidement, sélectivement, et réversiblement. Le neurone peut être soit hyperpolarisé (éteint) soit dépolarisé (excité). L’avantage des opsines animales est d’être sensibles à un signal lumineux plus faible grâce au système d’amplification permis par les récepteurs couplés aux protéines G (4). Les opsines microbiennes utilisées pour l’optogénétique ne sont pas sensibles à des signaux de faible intensité lumineuse.
Expression des opsines dans les différents types cellulaires rétiniens
L’introduction d’opsines microbiennes dans les différents types de neurones rétiniens est rendue possible par des vecteurs viraux. Ces neurones rétiniens deviennent ainsi sensibles à la lumière et font usage de photorécepteurs artificiels (Figure). L’avantage de cette stratégie thérapeutique est qu’elle peut s’adresser aux patients atteints de dégénérescences rétiniennes génétiques des photorécepteurs, quelle que soit la mutation impliquée. Ce type de restauration visuelle présente aussi l’avantage d’être indépendant des interactions avec l’épithélium pigmentaire rétinien.
La transfection peut s’effectuer à différents niveaux de la circuiterie neuronale rétinienne (Fig. 1), et selon le type de neurones rétiniens ciblés par la transfection, la précision du signal visuel obtenu, et son degré de contraste temporal et spatial seront variables. Si les corps cellulaires des cônes sont encore présents alors qu’ils ont perdu leurs segments externes et donc leur photosensibilité, il est possible de transfecter ces cônes et de restaurer leur photosensibilité. En l’absence de photorécepteurs résiduels, il est possible de transfecter les cellules bipolaires. Enfin, il est aussi possible, en cas de dégénérescence, des photorécepteurs et des cellules bipolaires de transfecter les cellules ganglionnaires. Toutefois, la transfection des cellules ganglionnaires ne permet pas de traitement du signal lumineux par les interneurones des couches intermédiaires rétiniennes, et donc pas de contraste temporel ou spatial du signal lumineux.
Une stratégie consiste à faire exprimer l’halorhodopsine par les cônes dormants survivants rétiniens. La faisabilité de cette stratégie a été démontrée chez la souris par l’équipe du Pr Botond Roska à l’Institut Friedrich Miescher, Bâle en Suisse. Chez la souris cette technique a permis d’obtenir une restauration du signal visuel d’une étonnante précision, avec inhibition latérale et sélection directionnelle, et guidage visuel du comportement (5).
Ce sont des vecteurs viraux qui ont été principalement utilisés pour délivrer des gènes d’intérêt dans les cellules rétiniennes. Les adénovirus (Adeno-Associated Virus, AAV) sont naturellement adaptés pour transfecter les cellules rétiniennes. L’injection sous-rétinienne d’adénovirus a été démontrée efficace, et bien toléré avec une réaction inflammatoire minime dans l’œil dans de nombreux essais cliniques (4). Les injections sous-rétiniennes de différents sérotypes d’AAV peuvent délivrer des gènes d’intérêt dans divers types cellulaires rétiniens : les cellules gliales, l’épithelium et plusieurs types de neurones rétiniens.
Premier essai clinique thérapeutique chez l’homme
Essai clinique ouvert de Phase 1/2a PIONEER
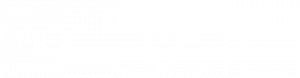
L’essai clinique ouvert non randomisé de Phase 1/2a appelé PIONEER a été conçu pour évaluer la tolérance (objectif primaire) et l’efficacité (objectif secondaire) d’un traitement pour les patients atteints de rétinite pigmentaire non syndromique à des stades très avancés. Ce traitement combine une injection intra-vitréenne d’un vecteur optogénétique (GS030-Drug Product) et le port d’un dispositif optique à type de lunettes particulières comprenant une caméra neuromorphique, une source LED (580-610 nm) et une matrice à micro-miroirs (GS030-Medical Device) (Fig. 2). La preuve du concept et les études de dose ont été préalablement validées au cours d’études chez le primate non humain.
Il s’agit d’une étude sponsorisée par GenSight Biologics, avec escalade de dose, non randomisée. L’étude est multicentrique entre Paris (CHNO des 15-20), Pittsburg (UPMC Eye Center), et Londres (Moorfields Eye Hospital), et prévoit d’inclure 18 patients âgés de 18 à 75 ans. Il est prévu d’évaluer 3 cohortes de 3 patients, avec escalade de dose, puis une extension de cohorte à la dose maximale tolérée.
Gène porteur d’une opsine dérivée d’une algue rouge et lunettes à réalité augmentée
Le vecteur viral est un AAV encodant une protéine channelrhodopsine (ChrimsonR) fusionnée avec une protéine rouge fluorescente tdTomato. Ce vecteur optogénétique est administré dans l’œil en une seule injection intra-vitréenne, avec pour cible les cellules ganglionnaires rétiniennes fovéolaires.
Le pic de sensibilité de la protéine ChrimsonR est à 590 nm (couleur ambre). Le choix de cette longueur d’onde déplacée vers le spectre rouge a été fait car considéré moins toxique pour la rétine que les longueurs d’onde bleues utilisées pour activer de nombreuses autres opsines. Un photorécepteur humain et ses opsines équipées d’un système d’amplification sont sensibles à un seul photorécepteur. Par comparaison, les opsines d’algue utilisées dans cet essai n’ont pas de système d’amplification et sont incapables de produire un signal pour de faibles intensités lumineuses.
Les patients doivent donc porter des lunettes spécialement conçues à réalité augmentée. Ces lunettes comportent une caméra biomimétique qui enregistre la scène visuelle, capable d’extraire les contours des objets, et de détecter des changements d’intensité pixel par pixel, comme des évènements distincts afin de la projeter en temps réel sur la rétine dans la longueur d’onde de sensibilité de l’opsine (595 nm, ambrée). Cela permet une captation contrastée de la scène visuelle. Le patient peut par exemple localiser, compter et saisir des objets placés devant lui en les balayant avec les lunettes.
Résultats de l’étude : tolérance
Le patient traité dans l’étude avait 58 ans, et avait été diagnostiqué avec une rétinopathie pigmentaire il y a 40 ans. Son acuité visuelle était limitée à une perception lumineuse.
L’œil avec l’acuité visuelle la plus faible a été traité avec une injection intra-vitréenne du vecteur optogénétique. Le patient a été surveillé lors de 15 visites pendant 84 semaines. L’examen ophtalmologique incluant un OCT, des rétinophotos couleur et en autofluorescence n’a pas mis en évidence d’inflammation intra-oculaire ni de modification anatomique rétinienne. Le patient a gardé sa perception lumineuse durant toute la période de surveillance. La surveillance n’a pas non plus mis en évidence d’effet indésirable systémique ou ophtalmologique. Les lunettes à réalité augmentée ont été testées trois fois avant l’injection intra-vitréenne. Quatre mois et demi après l’IVT, un entraînement visuel en utilisant les lunettes a été débuté et le patient a commencé à ressentir des signes d’amélioration visuelle en utilisant les lunettes 7 mois après l’IVT. L’entraînement visuel a lui commencé quelques mois après l’IVT, car c’est le temps de stabilisation de la transfection et d’expression de la protéine opsine.
Résultats de l’étude : efficacité : récupération visuelle partielle
La restauration visuelle a été analysée par des tests psychophysiques sous 3 conditions :
(1) avec les deux yeux sans les lunettes (vision naturelle binoculaire) ;
(2) œil traité ouvert et œil adelphe couvert sans les lunettes (vision monoculaire naturelle) ;
(3) œil traité ouvert stimulé avec les lunettes et œil adelphe couvert.
Le premier test a consisté à percevoir, localiser et toucher un objet simple placé sur une table. Les objets étaient soit grands (12 X 17,5 cm2), soit petits (3 X 5,5 cm2). Les objets étaient montrés un par un avec des degrés de contraste variable et positionnés sur une table à une distance de 60 cm de l’œil du patient.
Le patient a été capable de percevoir, localiser et toucher un objet simple de grande taille dans 92 % des cas seulement en cas de stimulation par les lunettes et pas dans les conditions naturelles sans stimulation. Le succès du test était significativement plus élevé pour les objets de grande taille (92 %) que pour les petits objets (36 %). Il était également indépendant des degrés de contraste, ce qui suggère que même les signaux de faible contraste ont pu générer suffisamment d’activité rétinienne pour produire une perception. Le taux de succès était similaire pour les 3 tâches : percevoir, localiser et toucher, ce qui signifie que le patient était capable de coordonner son système moteur avec cette perception visuelle.
Le deuxième test a consisté à percevoir, localiser, compter et toucher plusieurs objets (2 ou 3). Comme pour le premier test, le patient fut capable de compter, localiser et toucher les objets seulement avec la stimulation par les lunettes et dans 63 % des cas, indépendamment des degrés de contraste. Cette récupération visuelle partielle a été maintenue au fil du temps pendant des séries de tests réalisées 5 mois après les premiers tests.
Dans les conditions de stimulation avec les lunettes, mais pas dans les conditions naturelles, le patient était capable d’identifier les passages piétons, d’en compter les bandes blanches. Il était aussi capable d’identifier un plat, un téléphone, une tasse, un meuble dans une pièce, détecter une porte dans un couloir, avec l’usage des lunettes seulement. Le patient a aussi été enregistré lors de montée de marches dans la rue. Ces améliorations visuelles ont permis une amélioration significative de la qualité de vie du patient.
Afin de localiser les objets pendant les tests visuels, le patient a adopté une stratégie de balayer la scène avec les lunettes en bougeant la tête. Il est possible qu’il faille balayer la scène, car la zone d’activation optogénétique rétinienne était d’une surface limitée, permettant un champ de vision restreint.
Résultats de l’étude : corrélat cérébral de la récupération visuelle en EEG
Des enregistrements en EEG des signaux au niveau du cortex occipital ont été modulés par la présence ou l’absence d’un objet visuel. Les enregistrements en EEG suggèrent que l’activité rétinienne produite par la stimulation optogénétique s’est propagée jusqu’au cortex visuel primaire et en a modulé l’activité. La stimulation rétinienne optogénétique par un objet perçu a produit une désynchronisation des oscillations des ondes alpha sur l’enregistrement de l’EEG du cortex occipital. La diminution des ondes alpha dans le cortex visuel a été associée à une augmentation d’excitabilité du cortex visuel. La désynchronisation alpha corticale occipitale induite par la stimulation optogénétique rétinienne est une confirmation neurophysiologique de la récupération visuelle partielle du patient.
Conclusion
et perspectives
En résumé, les tests psychophysiques et neurophysiologiques ont démontré que la stimulation par optogénétique des cellules ganglionnaires rétiniennes fovéolaires, par le biais d’une projection lumineuse associée à une caméra au niveau de lunettes à réalité augmentée, est une voie prometteuse pour restaurer partiellement la vue de patients aveugles par suite de dystrophies rétiniennes avancées. L’avenir permettra peut-être de transfecter par optogénétique les cônes dormants ou les cellules bipolaires de la rétine humaine afin d’obtenir un signal visuel plus complexe et plus riche. Cela se ferait grâce à un certain degré de traitement de l’information au niveau des circuits neuronaux rétiniens, permettant un certain degré d’encodage de contraste temporal et spatial. Il se pourrait aussi que se développent des opsines avec système amplificateur sensibles à des stimulations lumineuses de plus faible intensité, en imaginant que la stimulation visuelle devienne moins dépendante des lunettes à réalité augmentée.
Cette stratégie de restauration visuelle est innovante et prometteuse car indépendante de la mutation génétique impliquée pour les dystrophies rétiniennes. Elle présente aussi le grand avantage d’être indépendante de potentielles reconnections avec l’épithélium pigmentaire rétinien qui pose des difficultés dans d’autres stratégies de restauration visuelle comme les greffes de cellules souches par exemple. En effet, elle utilise les neurones sains survivants au niveau rétinien et les transforme en photorécepteurs artificiels en leur transférant la capacité de transformer un signal lumineux en signal électrique puis en information visuelle.
Dès lors, cette stratégie pourrait, en théorie, s’appliquer à de très nombreuses pathologies rétiniennes dégénératives dès lors qu’au moins une couche de neurones rétiniens n’a pas dégénérée. On peut ainsi imaginer qu’elle puisse s’appliquer, à l’avenir, à d’autres types de dégénérescence rétinienne conduisant à une atrophie des photorécepteurs, comme la DMLA par exemple. •
Références
1. Liu X, Ramirez S, Pang PT et al. Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature 2012 ; 484 : 381-5.
2. Zhou T, Zhu H, Fan Z et al. History of winning remodels thalamo-PFC circuit to reinforce social dominance. Science 2017 ; 357 : 162-8.
3. Carta I, Chen CH, Schott AL et al. Cerebellar modulation of the reward circuitry and social behavior. Science 2019 ; 363 : eaav0581.
4. Duebel J, Marazova K et Sahel JA. Optogenetics. Curr Opin Ophthalmol 2015 ; 26 : 226-32.
5. Busskamp V, Duebel J, Balya D et al. Genetic reactivation of cone photoreceptors restores visual responses in retinitis pigmentosa. Science 2010 ; 329 : 413-7.
6. Sahel JA, Boulanger-Scemama E, Pagot C et al. Partial recovery of visual function in a blind patient after optogenetic therapy. Nature Medicine 2021 ; 27 : 1223-9.
Sarah Mrejen déclare n’avoir aucun lien d’intérêt concernant cet article.