La vasculopathie polypoïdale choroïdienne (VPC) a été décrite pour la première fois par Yannuzzi en 1982 (1). Elle est décrite comme une vascularisation anormale et ramifiée de la choroïdienne interne, associée à des dilatations vasculaires anévrismales pouvant être responsable de décollement de l’épithélium pigmentaire séreux et parfois d’un véritable tableau hémorragique. Si la VPC est le plus souvent idiopathique, elle peut également être secondaire à une DMLA exsudative, un staphylome myopique, une choriorétinopathie séreuse centrale/épithéliopathie rétinienne diffuse ou un naevus. Plus récemment, Freund intègre la VPC dans le spectre des pachychoroïdes (2).
Diagnostic de la VPC
Épidémiologie
À l’inverse de la DMLA exsudative, la prévalence de la VPC est plus marquée dans les populations asiatiques que dans les populations caucasiennes. L’âge de découverte (60 ans versus 70 ans dans la DMLA exsudative) reste plus précoce dans la VPC. Cependant, les deux entités partagent certains facteurs de risques environnementaux (le tabac) et génétiques en commun.
À la différence des populations asiatiques, la VPC chez les caucasiens touche plus souvent les femmes que les hommes, et est plus fréquemment bilatérale avec une localisation extrafovéolaire.
Fond d’œil
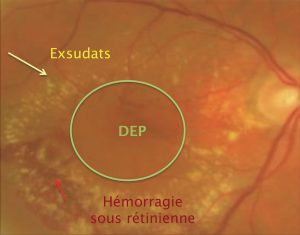
Au fond d’œil, le diagnostic de VPC peut être suspecté devant la présence d’un décollement de l’épithelium pigmentaire (DEP) avec des exsudats lipidiques plus ou moins associés à une hémorragie sous rétinienne. On peut aussi observer des lésions rouge-orangé, sphériques, visibles sous l’épithélium pigmentaire (EP), plus ou moins saillantes de tailles variables, uniques ou multiples. Ce tableau clinique s’accompagne le plus souvent de l’absence de drusen (Fig. 1).
La lecture de cet article est réservée aux abonnés.
Pour accéder à l'article complet
Découvrez nos offres d'abonnement
Abonnez-vous à la revue et accédez à tous les contenus du site !
- Tous les contenus de la revue en illimité
- Les numéros papier sur l'année
- Les newsletters mensuelles
- Les archives numériques en ligne
ou
Inscrivez-vous gratuitement sur Mon Œil.fr et bénéficiez de l'accès à de nombreuses catégories du site !
- Accès aux articles des catégories : Etudiants, Le jour où, Cabinet de curiosité, Conseil associé, Doc+, Mémo conseil, Molécule, Revue de presse, Pharmacovigilance
- Les newsletters mensuelles